Immobilisert CALB
CALB immobiliseres ved fysisk adsorpsjon på den svært hydrofobe harpiksen som er en makroporøs styren/metakrylatpolymer.Immobilisert CALB er egnet for applikasjoner i organiske løsemidler og løsemiddelfrie systemer, og kan resirkuleres og gjenbrukes mange ganger under passende forhold.
Produktkode: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★ Høyere aktivitet, høyere kiral selektivitet og høyere stabilitet.
★Bedre ytelse i de ikke-vandige fasene.
★ Fjern enkelt fra reaksjonssystemet, avbryt reaksjoner raskt og unngå proteinrester i produktet.
★Kan resirkuleres og gjenbrukes for å kutte ned kostnadene.
| Aktivitet | ≥10000PLU/g |
| pH-område for reaksjon | 5-9 |
| Temperaturområde for reaksjon | 10-60 ℃ |
| Utseende | CALB-IMMO100-A: Lysegult til brunt fast stoff CALB-IMMO100-B: Hvitt til lysebrunt fast stoff |
| Partikkelstørrelse | 300-500μm |
| Tap ved tørking ved 105 ℃ | 0,5 %–3,0 % |
| Harpiks for immobilisering | Makroporøs, styren/metakrylat polymer |
| Reaksjonsløsningsmiddel | Vann, organisk løsemiddel, etc., eller uten løsemiddel.For reaksjonen i noen organiske løsningsmidler kan 3 % vann tilsettes for å forbedre reaksjonseffekten |
| Partikkelstørrelse | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
Enhetsdefinisjon: 1 enhet tilsvarer syntesen av 1μmol per minutt propyllaurat fra laurinsyre og 1-propanol ved 60 ℃.Ovennevnte CALB-IMMP100-A og CALB-IMMO100-B tilsvarer immobiliserte bærere med forskjellige partikkelstørrelser.
1. Reaktortype
Det immobiliserte enzymet er anvendelig for både kjele-batch-reaktor og fast sjikt kontinuerlig strømningsreaktor.Det bør bemerkes for å unngå knusing på grunn av ytre kraft under fôring eller fylling.
2. Reaksjons-pH, temperatur og løsemiddel
Det immobiliserte enzymet bør tilsettes sist, etter at andre materialer er tilsatt og oppløst, og pH-justert.
Hvis forbruket av substrat eller dannelsen av produkt vil føre til endring av pH under reaksjonen, bør tilstrekkelig buffer tilsettes reaksjonssystemet, eller pH bør overvåkes og justeres under reaksjonen.
Innenfor temperaturtoleranseområdet til CALB (under 60 ℃), økte konverteringshastigheten med økningen i temperaturen.Ved praktisk bruk bør reaksjonstemperaturen velges i henhold til stabiliteten til substratet eller produktet.
Generelt er esterhydrolysereaksjonen egnet i vandig fasesystem, mens estersyntesereaksjonen er egnet i organisk fasesystem.Det organiske løsningsmidlet kan være etanol, tetrahydrofuran, n-heksan, n-heptan og toluen, eller et egnet blandet løsningsmiddel.For reaksjonen i noen organiske løsningsmidler kan 3 % vann tilsettes for å forbedre reaksjonseffekten.
3. Gjenbruk og levetid for CALB
Under passende reaksjonsbetingelser kan CALB gjenvinnes og gjenbrukes, og de spesifikke påføringstidene varierer med forskjellige prosjekter.
Hvis den gjenvunnede CALB ikke gjenbrukes kontinuerlig og må lagres etter gjenvinning, må den vaskes og tørkes og forsegles ved 2-8 ℃.
Etter flere runder med gjenbruk, hvis reaksjonseffektiviteten er noe redusert, kan CALB tilsettes passende og fortsette å brukes.Hvis reaksjonseffektiviteten reduseres alvorlig, må den skiftes ut.
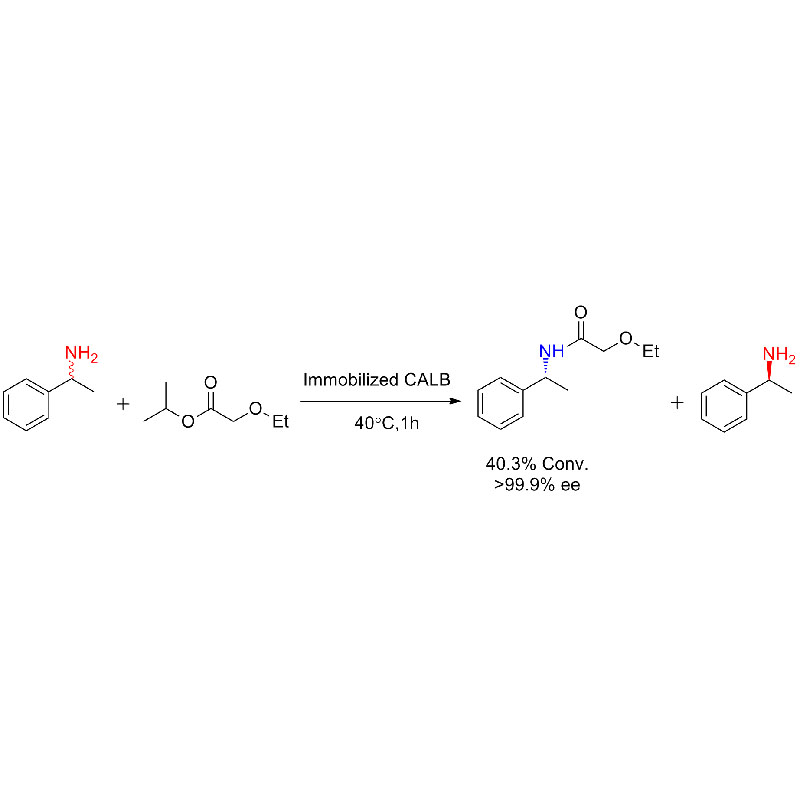
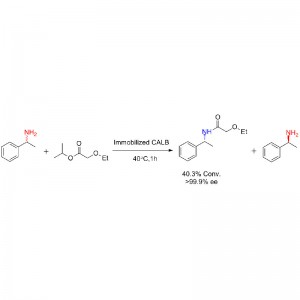
Eksempel 1 (aminolyse)(1):
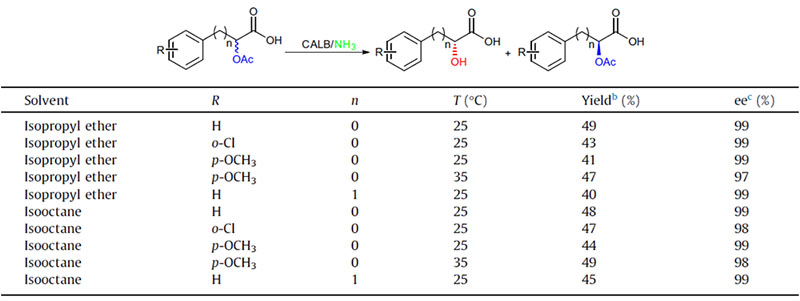
Eksempel 2 (aminolyse)(2):
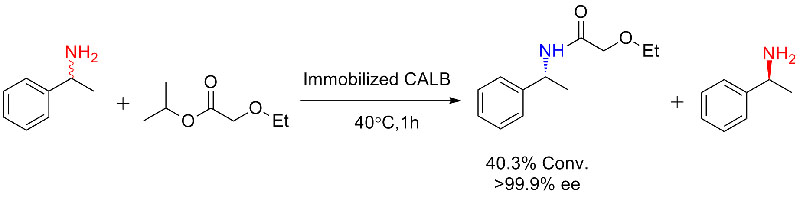
Eksempel 3 (polyestersyntese med ringåpning)(3):
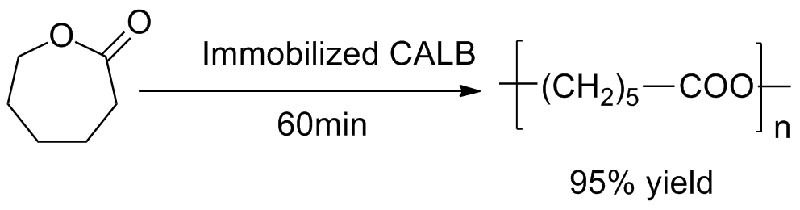
Eksempel 4 (Transesterifisering, regioselektiv av hydroksylgruppe)(4):
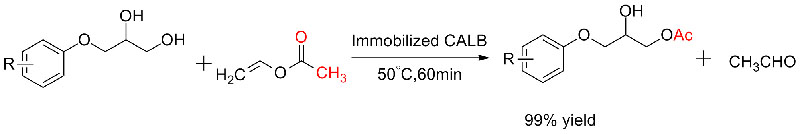
Eksempel 5(Transesterifisering, kinetisk oppløsning av racemiske alkoholer)(5):
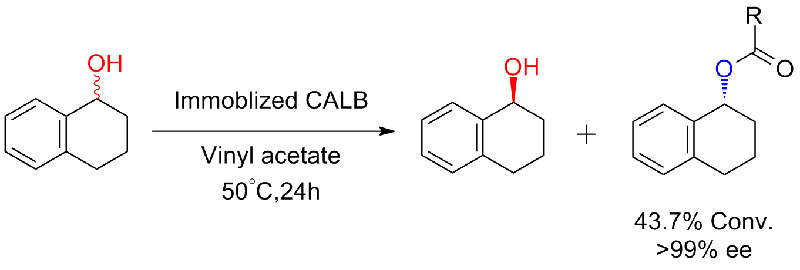
Eksempel 6 (Esterifisering, kinetisk oppløsning av karboksylsyre)(6):
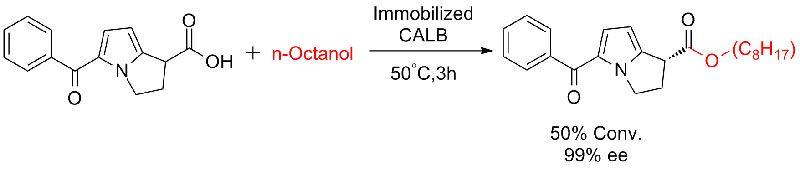
Eksempel 7 (Esterolyse, kinetisk oppløsning)(7):
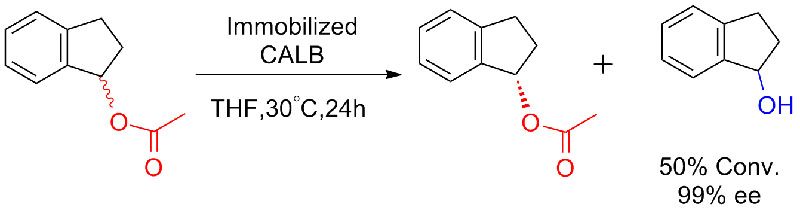
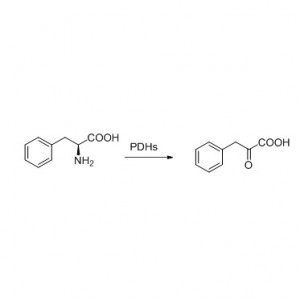
Eksempel 8 (Hydrolyse av amider)(8):
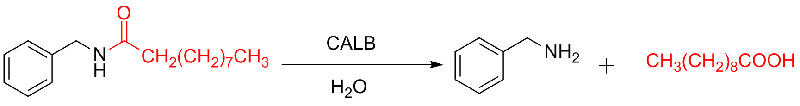
Eksempel 9 (Acylering av aminer)(9):
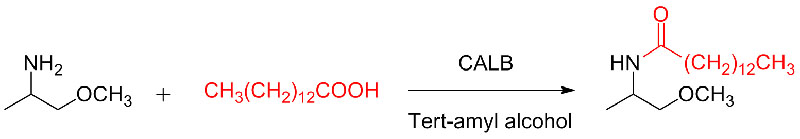

Eksempel 10 (Aza-Michael addisjonsreaksjon)(10):
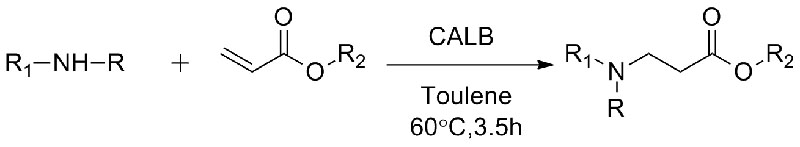
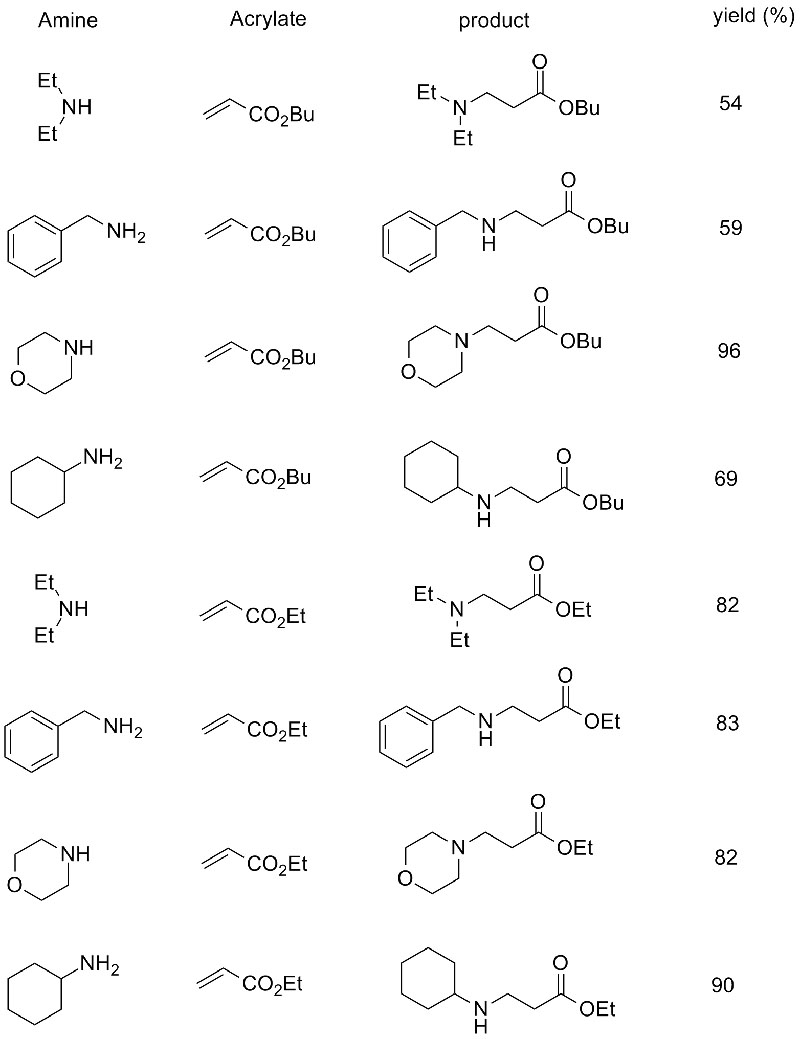
1. Chen S, Liu F, Zhang K, et al.Tetrahedron Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, et al.Tetrahedron, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et al.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. Eng.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA, et al.J. Mol.Catal.B: Enzym, 2016, 130: 58-69.
8. Gavil´an AT, Castillo E, L´opez-Mungu´AJ Mol.Catal.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et tal.J. Mol.Catal.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et al.Tetrahedron Lett, 2010, 51: 4455-4458.