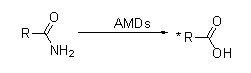
Amidase (AMD)
Enzymer:Er makromolekylære biologiske katalysatorer, de fleste enzymer er proteiner
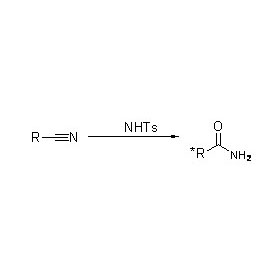
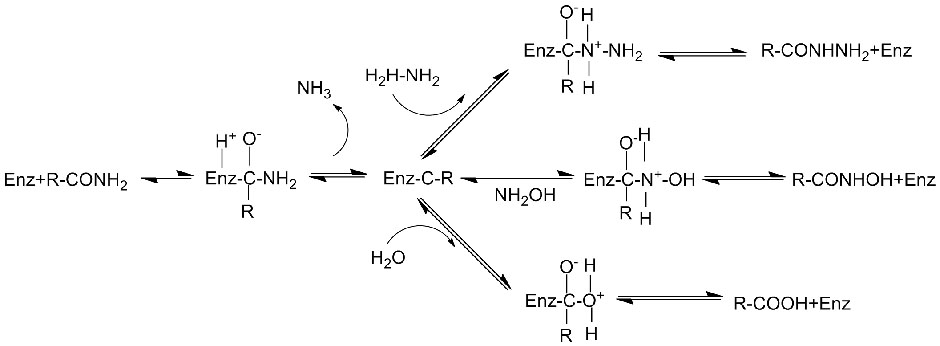
Amidase:Katalyser hydrolysen av forskjellige endogene og fremmede alifatiske og aromatiske amider ved å overføre en acylgruppe til vann med produksjon av frie syrer og ammoniakk.Hydroksamsyrer og andre organiske syrer er mye brukt som legemidler fordi de er bestanddeler av vekstfaktorer, antibiotika og tumorhemmere.Amidasene kan deles inn i R-type og S-type acylaser i henhold til katalysatorens stereoselektivitet.
I tillegg til å katalysere hydrolysen av amider, kan amidase også katalysere acyloverføringsreaksjoner i nærvær av co-substrater som hydroksylamin.
Amidase med forskjellige kilder har forskjellig substratspesifisitet, noen av dem kan bare hydrolysere aromatiske amider, noen av dem kan bare hydrolysere alifatiske amider, og noen hydrolysere α- eller ω-aminoamider.De fleste av aminene har god katalytisk aktivitet bare for acykliske eller enkle aromatiske amider, men for komplekse aromater har heterosykliske amider, spesielt amider med ortosubstituenter, generelt lav aktivitet (bare noen få enzymer viser bedre katalytiske effekter).
Katalytisk mekanisme:
| Enzymer | Produktkode | Produktkode |
| Enzympulver | ES-AMD-101~ ES-AMD-119 | et sett med 19 amidaser, 50 mg hver 19 elementer * 50 mg / element, eller annen mengde |
| Screening Kit (SynKit) | ES-AMD-1900 | et sett med 19 amidaser, 1 mg hver 19 elementer * 1 mg / element |
★ Høy substratspesifisitet.
★ Sterk kiral selektivitet.
★ Høy konverteringseffektivitet.
★ Mindre biprodukter.
★ Milde reaksjonsforhold.
★ Miljøvennlig.
➢ Enzymscreening bør utføres for spesifikke substrater på grunn av substratspesifisiteten, og få et enzym som katalyserer målsubstratet med best katalytisk effekt.
➢ Aldri kontakt med ekstreme forhold som: høy temperatur, høy/lav pH og organisk løsemiddel med høy konsentrasjon.
➢ Normalt bør reaksjonssystemet inkludere substrat, bufferløsning (enzymets optimale reaksjons-pH).Kosubstrater som hydroksylamin bør være tilstede i acyloverføringsreaksjonssystem.
➢ AMD bør tilsettes sist i reaksjonssystemet med optimal reaksjons-pH og temperatur.
➢ Alle typer AMD har ulike optimale reaksjonsbetingelser, så hver av dem bør studeres videre individuelt.
Eksempel 1(1):
Hydrolyseaktivitet til forskjellige amidsubstrater
| Substrat | Spesifikk aktivitet μmol min-1mg-1 | Substrat | Spesifikk aktivitet μmol min-1mg-1 |
| Acetamid | 3.8 | ο-OH-benzamid | 1.4 |
| Propionamid | 3.9 | p-OH-benzamid | 1.2 |
| Laktamid | 12.8 | ο-NH2benzamid | 1.0 |
| Butyramid | 11.9 | p-NH2benzamid | 0,8 |
| Isobutyramid | 26.2 | ο-Toluamid | 0,3 |
| Pentanamid | 22.0 | p-Toluamid | 8.1 |
| Heksanamid | 6.4 | Nikotinamid | 1.7 |
| Sykloheksanamid | 19.5 | Isonikotinamid | 1.8 |
| Akrylamid | 10.2 | Picolinamid | 2.1 |
| Metakrylamid | 3.5 | 3-Fenylpropionamid | 7.6 |
| Prolinamid | 3.4 | Indol-3-acetamid | 1.9 |
| Benzamid | 6.8 |
Reaksjonen ble utført i 50 mM natriumfosfatbufferløsning, pH 7,5, ved 70 ℃.
| Amider | Hydroksylamin | Hydrazin |
| Acetamid | 8.4 | 1.4 |
| Propionamid | 18.4 | 3.0 |
| Isobutyramid | 25,0 | 22.7 |
| Benzamid | 9.2 | 6.1 |
Reaksjonen ble utført i 50 mM natriumfosfatbufferløsning, pH 7,5, ved 70 ℃.
Relatert reagenskonsentrasjon: amider, 100 mM (benzamid, 10 mM);hydroksylamin og hydrazin, 400 mM;enzym 0,9 μM.
Eksempel 2(2):
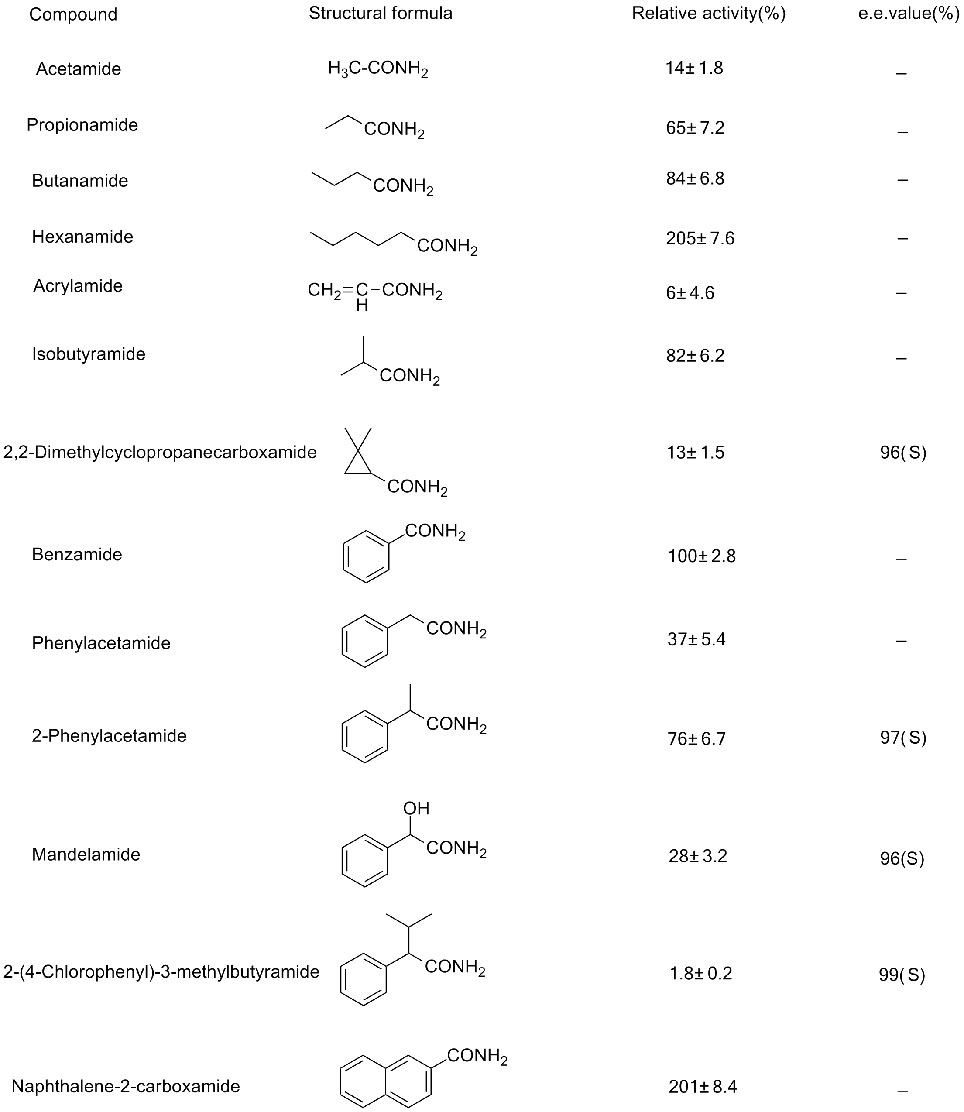
Eksempel 3(3):
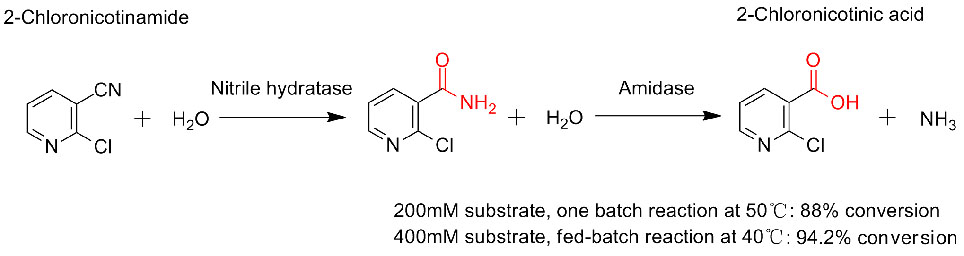
1. D'Abusco AS, Ammendola S., et al.Extremophiles, 2001, 5:183-192.
2. Guo FM, Wu JP, Yang LR, et al.Process Biochemistry, 2015, 50(8): 1400-1404.
3. Zheng RC, Jin JQ, Wu ZM, et al.Bioorganisk kjemi, 2017, tilgjengelig på nettet 7.